Una investigación abre la puerta para diseñar un fármaco que desactive el gen FOXO1 y así reprogramar las células del paciente.
COLUMBIA UNIVERSITY MEDICAL CENTER
Basta con manipular un único gen para convertir células gastrointestinales humanas en células productoras de insulina y así tratar la diabetes, una de las epidemias sanitarias del siglo XXI. Lo propone un equipo del Naomi Berrie Diabetes Center de la Universidad de Columbia (EE.UU.) que demuestra, en principio, que un medicamento podría reprogramar las células dentro del organismo de una persona con diabetes para que produjeran insulina.
Desde hace años se habla de la reprogramación celular como una de las vías para tratar la diabetes, explica el investigador Domenico Accili. «Pero hasta ahora no se había logrado fabricar una célula productora de insulina completamente funcional mediante la manipulación de un único gen». Según este experto, el hallazgo plantea la posibilidad de que las células «ineficaces» que hay en una persona con diabetes tipo 1 puedan ser reemplazadas con facilidad a través de la reprogramación de las células ya existentes en el propio paciente, sin la necesidad así de un trasplante de nuevas células creadas a partir de células madre embrionarias o adultas.
En la diabetes tipo 1 las células productoras de insulina del organismo son destruidas por el sistema inmune y desde hace décadas los investigadores han estado tratando de sustituir las células por distintos mecanismos. Y, aunque hoy día ya se fabrican células productoras de insulina en el laboratorio a partir de células madre, todavía no tienen todas las funciones naturales de las células beta del páncreas.
Por eso, muchos equipos trabajan en la posibilidad de transformar las células de los pacientes, de cualquier tipo, en células productoras de insulina. Este mismo equipo ya había demostrado que las células gastrointestinales del ratón se pueden transformar en células productoras de insulina; el estudio actual, que se publica en «Nature Communications», va un paso más lejos y demuestra que esta técnica también funciona en las células humanas.
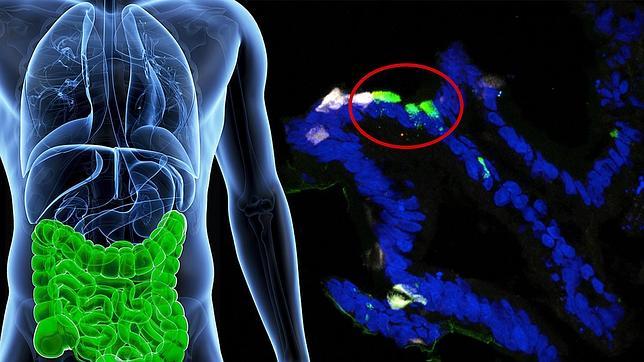
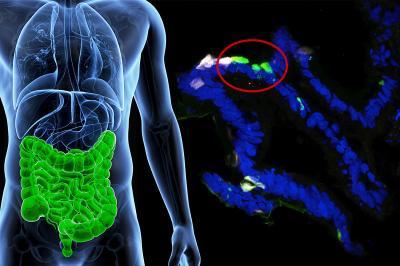
Los investigadores de Columbia fueron capaces de ‘enseñar’ a las células gastrointestinales humanas para que produjeran insulina en respuesta a circunstancias fisiológicas mediante la desactivación de los genes FOXO1.
Accili y Ryotaro Bouchi crearon primero un modelo de tejido del intestino humano con células madre pluripotentes humanas. A través de ingeniería genética desactivaron cualquier actividad del gen FOXO1 dentro de las células intestinales. Y después de siete días vieron que algunas de las células intestinales comenzaron a producir insulina y, lo más importante, sólo en respuesta a la glucosa.
En su trabajo previo realizado en ratones los investigadores comprobaron que la insulina producida por las células intestinales se liberaba en el torrente sanguíneo, se comportaba como la insulina normal y era capaz de normalizar los niveles de glucosa en sangre en ratones diabéticos. Este trabajo, publicado en «Nature Genetics» ya ha sido reproducido por otro grupo de investigadores independiente, lo que confirma los resultados.
Accili cree que al demostrar que las células humanas pueden responder de la misma forma que las células de ratón se ha despejado el obstáculo principal; «ahora podemos seguir adelante para tratar de hacer que este tratamiento sea una realidad». Y la clave, explica, será encontrar una fármaco capaz de pueda inhibir FOXO1 en las células gastrointestinales de los pacientes con diabetes.