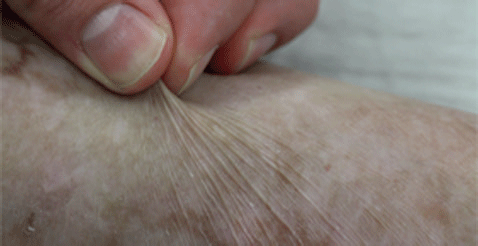
Hace dos años los médicos del Hospital infantil de Bochum, en Alemania, se encontraron con un dilema médico: ofrecer una terapia experimental que apenas había salido del laboratorio o ver morir a un niño de 7 años sin el 60 por ciento de su piel. El pequeño tenía epidermolisis bullosa, una enfermedad genética cruel que transforma la dermis en un tejido tan frágil que basta el roce de un jersey para generar ampollas y lesiones como las de una quemadura de tercer grado. Por eso también se conoce esta patología como la enfermedad de la «piel de cristal o «piel de mariposa».
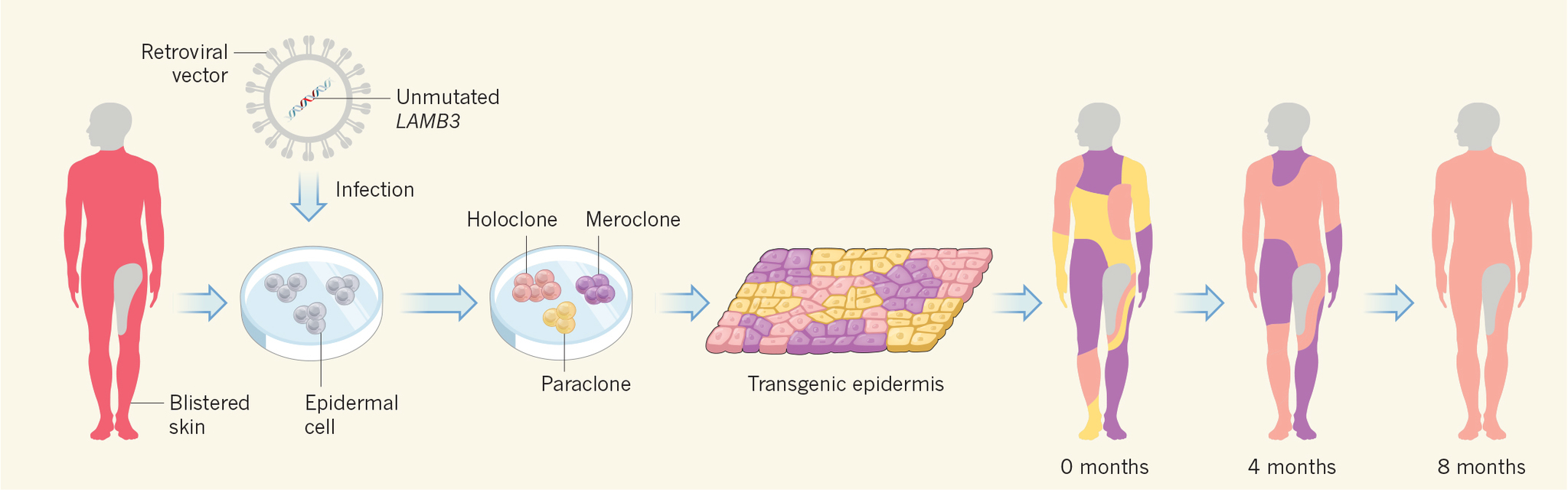
El niño se moría. Su aspecto era como el de un gran quemado: su espalda, las piernas, los brazos... parecían completamente abrasados y había contraído una grave infección. La única opción posible era probar una terapia génica experimental que consistía en hacer un injerto de piel sana, fabricado en el laboratorio. El equipo del dermatólogo italiano Michele De Luca le fabricó una nueva dermis a partir de sus propias células de la piel. Bastó con tomar una pequeña biopsia de cuatro centímetros de una de las pocas zonas del cuerpo del niño que aún permanecían intactas.
En el laboratorio aislaron las células con más capacidad de regeneración (queratinocitos), los cultivaron y modificaron genéticamente para corregir la alteración genética que causa la enfermedad. Lo hicieron con un retrovirus como vector, una especie de «taxi» biológico para introducir el gen corregido en el ADN de las células de la piel. Después se expandió esa nueva piel sana en el laboratorio y 23 días más tarde esos cuatro centímetros se convirtieron en casi un metro de piel lista para injertar. El nuevo injerto se colocó en la pierna del paciente. No hubo rechazo y ocho meses después había logrado regenerar por completo el 80 por ciento de su dermis.
Hoy a los dos años de este tratamiento a la desesperada, el niño no solo sigue vivo sino que toda su dermis se ha regenerado, según documenta el equipo de Michele de Luca en la prestigiosa revista «Nature». Los resultados son espectaculares, aunque aún no se puede hablar de curación porque la patología afecta a todas las células del organismo. «La enfermedad en sí misma no está curada, pero se ha regenerado toda la zona dañada. El pequeño en este tiempo no ha vuelto a tener ampollas y lesiones y sigue sin tratamiento dos años después», explica el doctor De Luca. Es la primera vez que un tratamiento contra la «piel de mariposa» logra una recuperación tan espectacular.
«Es un hito, Michele de Luca ha hecho posible lo imposible», no duda Raúl de Lucas, dermatólogo infantil del Hospital La Paz de Madrid, uno de los centros de referencia en España para el tratamiento de la «piel de mariposa». De Lucas conoce bien la tragedia de esta enfermedad: «Tengo a mi cargo 116 pacientes, todos son casos dramáticos. No son solo niños enfermos, son 116 dramas y 116 familias afectadas».

En esta unidad se sigue de cerca cualquier avance y más los del italiano que firma ahora este trabajo en la revista «Nature» porque es uno de los grandes expertos en esta enfermedad y el que más experiencia tiene. Casi todos los pasos se habían dado en el laboratorio y con experimentación animal. Antes de tratar a este niño a vida o muerte, solo había probado su técnica en dos pacientes que tenían pequeñas úlceras.
«Los buenos resultados de la investigación nos vuelven a ilusionar para seguir investigando», asegura Raúl de Lucas. El Hospital La Paz ya lo hace en colaboración con investigadores del Ciemat y la Universidad Carlos III de Madrid. El próximo año quieren poner en marcha un ensayo clínico con una terapia alternativa al injerto de piel. Consistirá en la administración intravenosa de células madre mesenquimales, obtenidas de la médula ósea de un donante emparentado.
El Ciemat lleva años investigando en cultivos de piel. De sus laboratorios han salido injertos para tratar a grandes quemados. También han ensayado con terapia génica, con una estrategia similar a la que ahora publica la revista «Nature». El futuro será otro, advierte José Luis Jorcano, investigador del Ciemat y del Carlos III. «Las técnicas de edición genética lo están cambiando todo, el famoso "corta-pega". En el Ciemat ya se ha corregido en el laboratorio la enfermedad con esta tecnología que repara el ADN. Será más segura que la utilización de retrovirus para transportar el gen corrector».