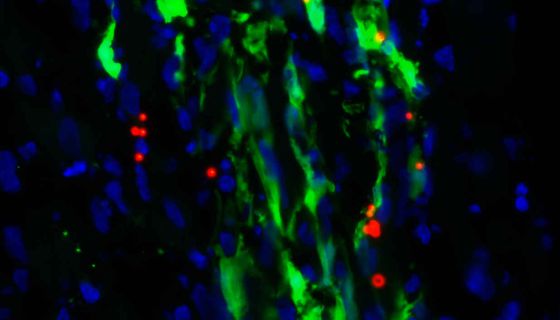
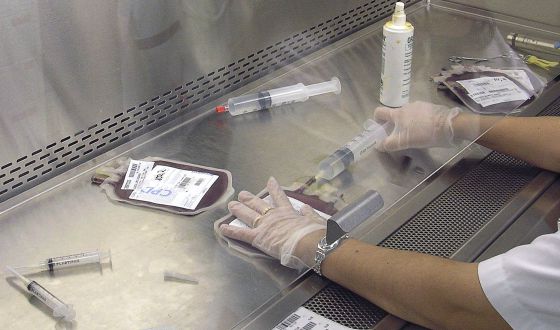
- Se obtienen de tejido cardiaco desechado durante intervenciones de corazón.
- Los siete pacientes a los que se ha tratado tienen una evolución muy favorable.
- El hospital Gregorio Marañón, de Madrid, encabeza la terapia en humanos.
El Hospital General Universitario Gregorio Marañón, de Madrid, encabeza una terapia pionera en humanos que utiliza células cardiacas alogénicas, es decir procedentes de donantes, para reparar el tejido dañado de un paciente tras sufrir un gran infarto agudo de miocardio.
En este primer ensayo clínico en humanos se tratará a 55 pacientes, aunque de momento se ha intervenido sobre siete. Su evolución, que es muy favorable, ha permitido constatar que estas células se pueden administrar con total seguridad y de forma sencilla en pacientes en una situación grave.
El ensayo ha sido presentado por el consejero de Sanidad de la Comunidad de Madrid, Javier Maldonado; el jefe de servicio de cardiología del hospital, Francisco Fernández-Avilés, además de la exministra Cristina Garmendia, presidenta de la empresa del grupo Genetrix, que ha desarrollado el estudio de este tipo de células, que pueden estar disponibles para cuando el paciente lo necesite.
Las células de donantes se obtienen de tejido cardiaco desechado durante intervenciones quirúrgicas, como cirugías valvulares, y se expanden en laboratorio hasta alcanzar la dosis necesaria de 35 millones por paciente.
Una cantidad que parece muy abultada, pero no tanto si se tiene en cuenta que de una biopsia se sacan cientos de millones de células, con lo que, según Garmendia, "hacen falta muy pocas biopsias de donante para tener una muy buena expansión de las mismas". En concreto, para el ensayo han sido necesarias tres.
El perfil del paciente es el de una persona que ha sufrido un gran infarto, con una afectación grave del tejido cardiaco y con mayor riesgo de padecer una insuficiencia cardiaca. Este tipo de infartados representan el 20% del total.
El momento idóneo para que se le administren las células es entre el quinto y el décimo día después de haber padecido este episodio en el corazón, cuando su situación clínica se ha estabilizado.
"Es muy atractivo poderlo hacer inmediatamente tras sufrir el infarto -ha comentado Fernández-Avilés-, pero hoy no nos atrevemos porque es un ambiente muy hostil para las células por la inflamación".
Las células se administran al enfermo por vía intracoronaria, con un procedimiento similar al que se utiliza para poner un stent, con un catéter muy pequeño y blandito que no produce ningún daño mecánico, según los especialistas.
El jefe de Cardiología ha aclarado que este tratamiento "no es para tratar la insuficiencia cardiaca, sino que es para prevenirla y pretende actuar sobre el tamaño de la cicatriz y la evolución de la forma y la función del ventrículo izquierdo".
Si el estudio evidencia que se puede conseguir reducir el tamaño de la escara y que evolucione de forma favorable el ventrículo izquierdo, "se producirá un impacto tremendo sobre el riesgo de desarrollar insuficiencia cardiaca en los próximos tres o cinco años".
Esto se podrá analizar cuando concluya el ensayo clínico con los 55 pacientes, que podría ser a finales de 2016. La terapia en principio no sería efectiva en pacientes que ya tienen una alteración crónica del tejido cardiaco.
Según el experto, "cuanto más se aleja uno del episodio agudo la posibilidad de que las células solas hagan algo va disminuyendo de una forma rápida". Para esa circunstancia, en lo que haría falta trabajar sería en una alternativa al trasplante.
El ensayo ha sido avalado por la Comisión Europea a través del proyecto denominado CAREMI, en el que participan más de veinte entidades europeas.
En el estudio colaborarán también otros centros sanitarios, como el Hospital de Navarra, el Universitario de Donostia, el Clínico Universitario de Valladolid, el Vall d'Hebrón (Barcelona) y también los universitarios de Salamanca, Virgen de la Victoria de Málaga y Valencia. También la Fundación La Fe de Valencia, el Centro de Cirugía Mínimamente Invasiva Jesús Usón (Cáceres), la Universidad Católica de Lovaina (Bélgica) y el Saint Louis de París.