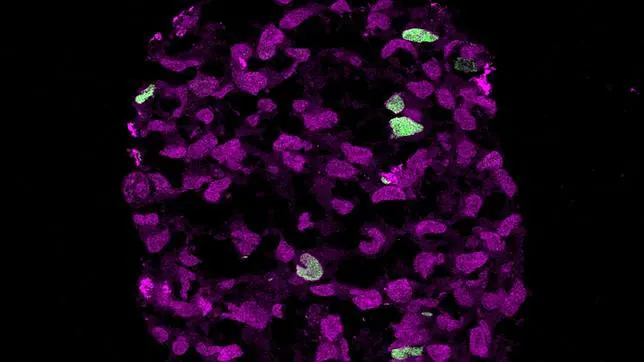
La información obtenida permitirá avanzar en la comprensión de las enfermedades asociadas con el envejecimiento.
Científicos de la Universidad de Cambridge y del Instituto Weizmann han creado por vez primera células germinales primordiales -células que pueden convertirse en óvulos y espermatozoides- utilizando células madre embrionarias humanas. Es la primera vez que se hace en humanos, aunque ya se había logrado utilizando células madre de roedores. El estudio se publica en la revista «Cell».
Cuando un óvulo es fecundado por un espermatozoide éste comienza a dividirse en un grupo de células conocidas como blastocistos, que es la etapa previa al embrión. Dentro de esta ‘bola’ de células, algunas células forman la masa celular interna -que se desarrollará en el feto- y otras forman la pared exterior, que se convertirá en la placenta. A continuación, las células de la masa celular interna se reprograman para que se conviertan en células madre, es decir, en células que tienen el potencial de convertirse en cualquier tipo de célula en el cuerpo. Y únicamente un pequeño número de dichas células se convierten en células germinales primordiales, que poseen el potencial de convertirse en células germinales (espermatozoides y óvulos), que son las encargadas de trasferir la información genética de la descendencia a su propia descendencia en el futuro.
«La creación de células germinales primordiales es uno de los primeros acontecimientos que ocurre durante el desarrollo embrionario de los mamíferos», explica Naoko Irie, autor del trabajo y profesor del Instituto Gurdon Wellcome del Cáncer del Reino Unido en la Universidad de Cambridge. «Es una etapa que hemos logrado recrear utilizando células madre de ratones y ratas, pero hasta ahora pocos estudios han hecho esto utilizando sistemáticamente las células madre humanas. Y así hemos encontrado importantes diferencias entre el desarrollo embrionario de los humanos y el de los roedores, por lo que los resultados en ratones y las ratas no pueden extrapolarse directamente a los seres humanos».
Los investigadores encontraron que el gen SOX17 es fundamental para hacer que las células madre humanas se conviertan en PGC, una etapa conocida como ‘especificación’. Sin embargo, el equivalente de este gen del ratón no está involucrado en el proceso, lo que sugiere una diferencia clave entre el ratón y el desarrollo humano. Hasta ahora se sabía que SOX17 participaba en la programación de las células madre para que se convirtieran en células endodérmicas, que posteriormente se transforman en células del pulmón, intestino y el páncreas, pero esta es la primera vez que se ha visto su función en la etapa de ‘especificación’ de PGC.
Además los científicos han visto que también es posible inducir células PGC a partir de células adultas reprogramadas, como las células de la piel, lo que permitirá investigaciones sobre células específicas del paciente para avanzar en el conocimiento de la línea germinal, la infertilidad y los tumores de células germinales humanas.
La investigación también tiene implicaciones para la comprensión del proceso de la herencia ‘epigenética’. Aunque desde hace tiempo se sabe que nuestro medio ambiente, por ejemplo la dieta o hábitos de fumar, puede afectar a nuestros genes a través de un proceso conocido como metilación y que estos patrones de metilación se pueden transmitir a la descendencia, ahora han demostrado que durante la etapa de especificación PGC, se inicia un programa para borrar estos patrones de metilación. Sin embargo, los rastros de estos patrones pueden ser heredados, aunque aún no está claro por qué ocurre.
«Las células germinales son ‘inmortales’ en el sentido de que proporcionan un vínculo duradero entre todas las generaciones, es decir, llevan la información genética de una generación a la siguiente», explican los investigadores. La información obtenida en el estudio, añaden, es de sumo interés para avanzar en la comprensión de las enfermedades asociadas con el envejecimiento, que en parte podrían estar causadas por mutaciones epigenéticas acumulativas.
Según Jacob Hanna, del Instituto Weizmann, «tener la capacidad de crear PGC humanas en el laboratorio nos permitirá investigar el proceso de diferenciación en el nivel molecular». Por ejemplo, señala, «hemos visto que las células ‘naive’ pueden convertirse en las células germinales primordiales, pero que después de una semana en condiciones convencionales de crecimiento pierden esta capacidad. Y nos gustaría saber por qué: ¿Qué hay en los estados de células madre humanas que las hace más o menos competentes? Son las respuestas a estas preguntas básicas las que, en última instancia, hacen avanzar la tecnología de células iPS hasta su uso médico».