http://www.tendencias21.net/Crean-en-laboratorio-minicerebros-que-sobreviven-hasta-10-meses_a23186.html
http://sociedad.elpais.com/sociedad/2013/08/28/actualidad/1377706562_874144.html
http://www.lavanguardia.com/ciencia/20130829/54379856954/prototipo-cerebro-humano-celulas-madre.html
http://www.rtve.es/noticias/20130829/crean-mini-cerebros-partir-celulas-madre-para-estudiar-enfermedades-neurologicas/743786.shtml
http://www.abc.es/sociedad/20130828/abci-minicerebros-laboratorio-201308281837.html
http://www.elmundo.es/elmundosalud/2013/08/28/biociencia/1377716999.html?cid=GNEW970103
Un equipo de científicos europeos ha desarrollado un sistema para producir ‘organoides cerebrales’ a partir de cultivos de células madre. El resultado es un tejido en 3D similar a las primeras etapas del cerebro humano, lo que permite estudiar su evolución y las enfermedades asociadas, como la microcefalia.
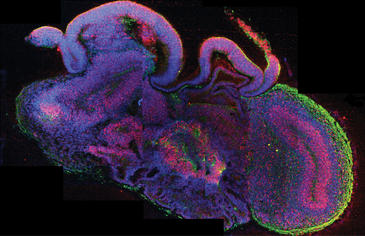
Sección de un 'organoide cerebral' con regiones diferenciadas. En rojo se observan células madre neuronales y en verde, neuronas. / Madeline A. Lancaster
El desarrollo del cerebro humano es uno de los grandes misterios de la biología, pero un grupo de investigadores austriacos y británicos presentan en Nature una técnica para generar tejido cerebral que ayudará a avanzar en su estudio.
El equipo, liderado desde el Instituto de Biotecnología Molecular (IMBA) de la Academia Austriaca de Ciencias, ha conseguido crear ‘organoides cerebrales’ partiendo de un cultivo de células madre pluripotentes. Estas se pueden obtener de embriones humanos o reprogramarse a partir de células adultas.
"Hemos generado un ‘neuroectodermo’, una capa de células de la que se deriva el sistema nervioso”, destaca el autor principal, Jürgen Knoblich, del IMBA. “Luego, los fragmentos de este tejido se mantienen en un cultivo tridimensional y se embeben en gotas de un gel que actúa de andamiaje para que pueda crecer”.
“Para favorecer la absorción de los nutrientes –continúa–, transferimos después las gotas de gel a un biorreactor giratorio, y en unas tres o cuatro semanas ya están formadas y definidas las regiones cerebrales”.
Aunque Lancaster, Knoblich y sus colegas han tenido que poner a punto muchas condiciones experimentales —medios de cultivo, factores de crecimiento, rotación de los biorreactores—, la verdadera clave de su éxito está en la asombrosa capacidad de autoorganización de las células humanas en desarrollo. En un sentido profundo, las células madre de su experimento han logrado hacer un minicerebro humano porque eso es exactamente lo que hacen durante el desarrollo normal. El truco es engañarlas para que crean que se hallan en su entorno natural, y no en el tubo de ensayo en el que están.
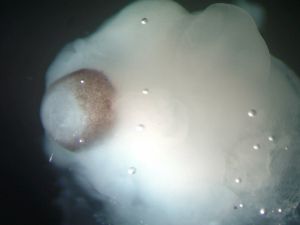
Imágenes del microcerebro con el desarrollo retinal. / MADELINE A. LANCASTER (NATURE)
La idea de cultivar cerebros a partir de células madre no es una genialidad de los investigadores de Viena, sino que ha ido cristalizando gradualmente durante el último lustro. Ya en 2008 otros laboratorios mostraron, trabajando con células madre de ratón, que las células madre embrionarias maduradas en placas de cultivo eran capaces de generar por sí solas una serie de ondas de neuronas, en un proceso similar al que ocurre durante el desarrollo del córtex cerebral de los mamíferos. Trabajos posteriores obtuvieron evidencias de que las células madre podían agregarse en suspensión y autoorganizarse en estratos concéntricos similares a las seis capas que forman el córtex humano, la arrugada y fea estructura más exterior del cerebro que fue premonitoriamente descrita por Cajal y constituye la sede de nuestra mente.
Pero los científicos de Viena han ido ahora mucho más allá. Sus organoides cerebrales crecen ordenadamente hasta alcanzar los cuatro milímetros de diámetro, lo que representa un estadio similar al desarrollo cerebral de un embrión de nueve semanas. Subir de ahí no es posible sin un sistema circulatorio que alimente de oxígeno y nutrientes al tejido, como destaca Oliver Brüstle, neurocientífico de la Universidad alemana de Bonn, y pueden mantenerse en un reactor de forma aparentemente indefinida: 10 meses por ahora, pero quién sabe cuánto más. Los organoides presentan una cavidad interna similar a los ventrículos del cerebro que transportan el fluido cerebroespinal, y también estructuras similares a los plexos coroideos que generan ese fluido. Los tejidos que rodean ese ventrículo parecen diferenciarse, según todas las evidencias anatómicas y moleculares, en las distintas áreas anteriores, medias y posteriores típicas del cerebro normal en desarrollo. Estas regiones incluyen las capas neuronales de la corteza cerebral y el hipocampo, donde reside la capacidad de aprendizaje.
Casi todo lo que se sabe sobre la biología humana se ha inferido investigando sistemas modelo mucho más accesibles a la experimentación, como levaduras, gusanos, moscas y ratones. Una de las mayores sorpresas que ha deparado la genómica contemporánea, por ejemplo, es que la lista de genes de los ratones y los humanos son virtualmente idénticas. Si en algo nos distinguimos de un ratón, sin embargo, es precisamente en el tamaño del córtex cerebral, y este es uno de los grandes problemas a los que se enfrenta el estudio de los fundamentos biológicos de las enfermedades neurológicas.
Un buen ejemplo es la microcefalia, una enfermedad genética —o un conjunto de ellas, puesto que se conocen mutaciones en cinco genes distintos que conducen a esta malformación— que devuelve el cerebro humano al tamaño del de un australopiteco: en cierto sentido, una regresión evolutiva a los bosques africanos de hace cuatro millones de años.
A diferencia de enfermedades que afectan a otros órganos, la microcefalia no se puede investigar bien con animales de laboratorio porque su cerebro es demasiado diferente del humano. Esta dificultad se ha podido superar ahora creando un organoide con células madre derivadas de un paciente con microcefalia.
Al compararlo con organoides derivados de personas sanas, se ha observado que este caso de microcefalia se produce por una formación excesiva de neuronas en una fase temprana del desarrollo cerebral. El exceso de neuronas prematuras se acompaña de un déficit de aquellas células madre que deberían dar origen más adelante a los distintos tipos de células que forman el cerebro.
Las posibilidades de experimentación que ofrecen los organoides han permitido identificar el gen CDK5RAP2 como el responsable de la microcefalia: es un funcionamiento defectuoso de este gen lo que causa un desarrollo anómalo del sistema nervioso.
Otro de los chocantes logros de Lancaster y sus colegas es que, partiendo de células madre reprogramadas a partir de células de pacientes de microcefalia, han conseguido desarrollar organoides cerebrales que pueden suplir esa carencia y funcionar como modelos de esa malformación. Según sus datos, la microcefalia se debe a que las células precursoras de las neuronas se diferencian demasiado pronto como neuronas propiamente dichas, en lugar de seguir proliferando para multiplicar exponencialmente el tamaño del córtex. Es solo el principio de lo que promete convertirse en una línea de investigación radicalmente nueva.
En cualquier caso, estos tejidos cerebrales en 3D se asemejan a las primeras etapas de formación del cerebro humano, por lo que facilitan los estudios sobre la evolución de este órgano esencial.
Además, el método permite estudiar algunas enfermedades neurológicas humanas de una forma que no lo hacen los modelos con ratas u otros animales de laboratorio, cuyo cerebro es menos complejo.
“Me parece una técnica muy creativa e interesante, y mi predicción es que este nuevo enfoque tendrá un impacto importante en el futuro”, concluye el neurobiólogo español Rafael Yuste, de la Universidad de Columbia (EEUU), que colidera el proyecto BAM/BRAIN para crear un mapa detallado de la actividad cerebral, financiado por la administración Obama con 100 millones de dólares.
"Esta investigación ofrece un nuevo instrumento que promete ser de gran importancia para comprender las causas de trastornos de desarrollo del cerebro como el autismo y la esquizofrenia, así como para ensayar posibles tratamientos", sostiene Paul Matthews, neurocientífico del Imperial College de Londres que no ha participado en la investigación, en declaraciones recogidas por el Science Media Center del Reino Unido.
“El estudio es importante porque permite un modelo experimental interesante para estudiar el desarrollo de la corteza cerebral”, explica Juan A. de Carlos, Investigador del Instituto Cajal (CSIC) y experto en desarrollo del telencéfalo.
Zoltán Molnár, de la Universidad de Oxford, apunta: “Dudo que seamos capaces de crear un cerebro totalmente funcional en un futuro cercano, aunque algunos grupos en Japón sí podrían producir una glándula pituitaria relativamente madura o un ojo con métodos similares”. Este neurocientífico ve un gran potencial en esta técnica para el estudio de trastornos del desarrollo del cerebro en las primeras etapas. Sin embargo, no está claro que pueda utilizarse para patologías más complejas, como el autismo o la esquizofrenia.
“Lo que hace este trabajo particularmente interesante es que células procedentes de un paciente con microcefalia producen un organoide cerebral anormal, con aspectos semejantes a los que se observan en el paciente. Los investigadores demuestran que esas características anómalas se pueden “curar” reemplazando el gen defectuoso”, explica el neurocientífico Paul Matthews.
Zameel Cader, un neurólogo en el Hospital John Radcliffe, en Oxford (Reino Unido) ha declarado que se trata de "una investigación fascinante que amplía las posibilidades de la tecnología con células madre para comprender el desarrollo del cerebro, los mecanismos de las enfermedades y descubrir terapias".
Algo más excéptico se muestra Dean Burnnett, profesor de Psiquiatría de la Universidad de Cardiff, quien señala que "el cerebro humano es la cosa más compleja que conocemos en el universo, y tiene un número de conexiones e interacciones terriblemente elaboradas, ambas se dan entre sus numerosas subdivisiones y en el cuerpo en general. Decir que puedes replicar el trabajo del cerebro con un tejido en una placa de laboratorio es como inventar el primer ábaco y decir que puedes utilizarlo para hacer funcionar la última versión de Windows; hay una conexión, pero hay un gran camino por recorrer hasta que se consigan aplicaciones".
Falta ver, por tanto, si los organoides creados in vitro pueden desarrollarse para formar estructuras más complejas y qué enfermedades concretas se podrán investigar con esta nueva herramienta. Según Martin Coath, de la Universidad de Plymouth, "el minicerebro es prometedor, pero sólo estará claro cómo de prometedor después de tener muchos más buenos resultados".
¿Puede crearse una mente en el tubo de ensayo? La respuesta es que todavía no. Pero el énfasis parece estar hoy en la palabra todavía.
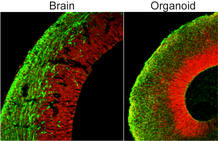
Comparación del mini cerebro (derecha) con una muestra de cerebro de ratón (izquierda). Ambos muestran células madre neurales y neuronas en rojo y verde. (Marko Repic and Madeline A. Lancaster)

Sistema biorreactor giratorio donde el mini cerebro vive hasta 10 meses. (Magdalena Renner)
Referencia bibliográfica:
Madeline A. Lancaster, Magdalena Renner, Carol-Anne Martin, Daniel Wenzel, Louise S. Bicknell, Matthew E. Hurles, Tessa Homfray, Josef M. Penninger, Andrew P. Jackson, Juergen A. Knoblich. “Cerebral organoids model human brain development and microcephaly”. Nature 500: 7464, 29 de agosto de 2013. Doi:10.1038/nature12517.
No hay comentarios:
Publicar un comentario