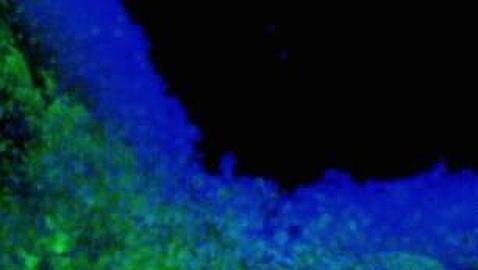
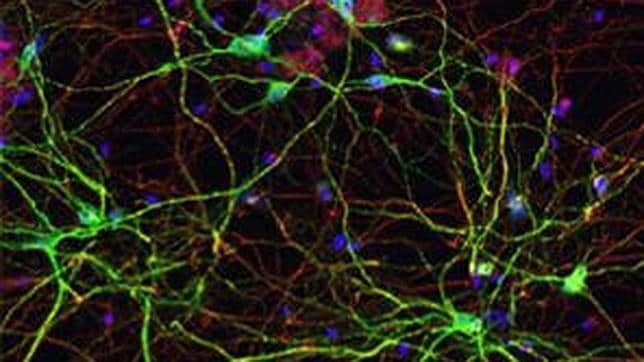
Los investigadores han producido organoides gástricos en 3D para estudiar la infección causada por la bacteria H.pylori, la causa principal de la enfermedad de úlcera péptica y cáncer de estómago.
La carrera para fabricar órganos en el laboratorio que sirvan para tratar y curar muchas enfermedades sigue su curso. Si hace una semana se lograba el primer intestino fabricado a partir de células madre, ahora la revista «Nature» presenta el primer estómago humano de laboratorio. Los investigadores del mismo centro, Hospital Infantil de Cincinnati, han empleado células madre pluripotentes para generar tejido del estómago humano funcional en tres dimensiones en un laboratorio. Y, según sus creadores, será una herramienta que permitirá investigar el desarrollo de un órgano clave en muchas enfermedades, que van desde el cáncer a la diabetes.
A partir de células madre pluripotentes humanas, capaces de convertirse en cualquier tipo de célula, los expertos del Hospital Infantil de Cincinnati, en colaboración con un equipo de la Universidad de Cincinnati (EE.UU.), han fabricado una versión en miniatura del estómago. En concreto han producido mini-estómagos (llamados organoides gástricos) para estudiar la infección causada por la bacteria H.pylori, la causa principal de la enfermedad de úlcera péptica y cáncer de estómago.
Los investigadores destacan que estos organoides gástricos humanos en 3D son una oportunidad para trabajar en el descubrimiento de nuevos fármacos, pero además para profundizar en el desarrollo de las primeras etapas del cáncer de estómago o estudiar algunos de los fundamentos de la diabetes relacionados con la obesidad. Además, apunta Jim Wells, también es la primera vez que los investigadores han producido en 3D el intestino anterior embrionario humano, un punto de partida prometedor para generar otros tejidos de órganos como los pulmones y el páncreas.
«Hasta este estudio nadie había generado células gástricas a partir de células madre pluripotentes humanas –señala Wells-. Además, hemos descubierto la manera de promover la formación de tejido gástrico en tres dimensiones con una arquitectura y composición celular compleja». Y esto, añade, es muy relevante porque las diferencias entre especies en el desarrollo embrionario y la arquitectura del estómago adulto hacen que el modelo de ratón no sea el óptimo para estudiar el desarrollo del estómago humano y sus enfermedades asociadas.
El hallazgo ofrece asimismo la posibilidad de investigar en la identificación de los procesos bioquímicos en el intestino que permiten a los pacientes sometidos a un bypass gástrico curarse de la diabetes antes de tener una disminución de peso significativa. No hay que olvidar la estrecha relación que hay entre la obesidad, la diabetes y el síndrome metabólico, una tríada que es ya una pandemia de salud pública. Y hasta ahora, reconoce Wells, uno de los problemas importantes para abordar estos y otros aspectos de salud relacionados con el estómago ha sido la falta de modelos de laboratorio fiables para simular con precisión la biología humana.
Estómago fabricado en el laboratorio
Tal y como se explica en el artículo de «Nature», la clave para fabricar los organoides gástricos humanos fue identificar los pasos involucrados en la formación normal del estómago durante la fase de desarrollo embrionario. Así, mediante la manipulación de estos procesos normales en una ‘placa Petri’, los científicos fueron capaces de «convencer» a las células madre pluripotentes para que se convirtieran en estómago. Al cabo de un mes, estos pasos promovieron la formación de organoides gástricos humanos en 3D que medían aproximadamente 3 mm de diámetro. Wells y sus colegas también utilizaron este enfoque para identificar qué mecanismo impulsa la formación del estómago normal en los seres humanos con el objetivo de entender qué es lo que va mal cuando el estómago no se forma correctamente.
Gracias a su nuevo estómago los investigadores pudieron descubrir la capacidad infectiva del H.pylori. En apenas 24 horas la bacteria había provocado cambios bioquímicos en el órgano. Los investigadores observaron que los organoides gástricos humanos imitaban fielmente las primeras etapas de la enfermedad gástrica causada por esta bacteria, incluyendo la activación de un gen del cáncer llamado c-Met y la rápida propagación de la infección en los tejidos epiteliales.