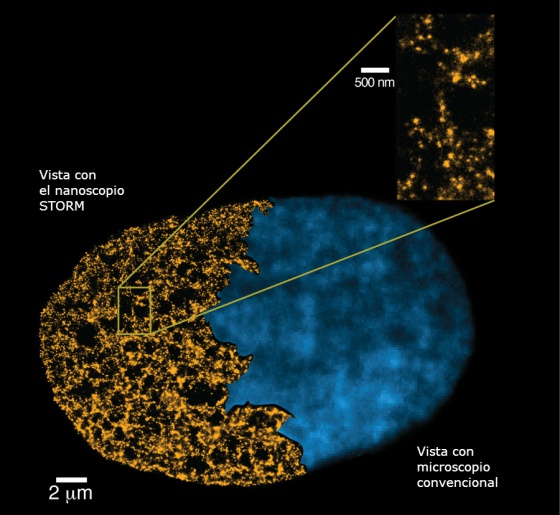
Vista del genoma con la nueva técnica óptica.
El núcleo de una célula humana alberga unos dos metros de material genético, nuestro libro de instrucciones. En estos dos metros, el ADN se empaqueta en cromosomas y estos se organizan en nucleosomas, unos ovillos de proteínas que dan lugar a la fibra de cromatina, una estructura con apariencia de collar de perlas. Por primera vez, los científicos han observado en animales, de forma no invasiva y con suficiente calidad los nucleosomas. Es una fotografía en alta resolución de nuestro genoma.
Hasta ahora se pensaba que los nucleosomas estaban muy compactados y se esparcían de forma regular en la cromatina. En cambio, nuevos experimentos con células madre y células adultas de humano y ratón muestran que se empaquetan de forma diferente. Además, el estudio añade que están separados por regiones de ADN libres de nucleosomas.
El matiz tiene grandes implicaciones. A escala nanométrica, de millonésimas partes de un milímetro, la arquitectura interna del genoma está correlacionada con el nivel de pluripotencia de la célula, su capacidad para diferenciarse en cualquier otro tipo celular. Cuanto más pluripotente es una célula menos rígido es el empaquetado de su material genético, según las conclusiones de un estudio publicado en la revista Cell por un equipo de biólogos del Centro de Regulación Genómica (CRG) y físicos del Instituto de Ciencias Fotónicas (ICFO), ambos en Barcelona.
“Hemos descrito un nuevo modelo que explica cómo se estructuran las fibras de cromatina”, subraya Pia Cosma, investigadora en el CRG y coautora del estudio, hecho con la técnica de microscopía galardonada con el último premio Nobel de Química. Este equipo introduce en la literatura científica el concepto de “puesta de huevos” para referirse a la heterogeneidad en los tamaños de los grupos de nucleosomas repartidos en nidadas a lo largo de la fibra de cromatina.
Mientras que en las células ya diferenciadas (una célula de hígado, de músculo, una neurona...) las nidadas de nucleosomas son densas, compactas y muy pobladas, en las células madre (que dan lugar a todas las demás) el número de nucleosomas por cada nidada es menor y su empaquetado es más laxo. Cosma intuye que la arquitectura de la cromatina en las células madre podría favorecer algunos factores de transcripción, las proteínas que regulan la activación de un gen o de un grupo de genes. “El ADN sería más accesible porque estaría más abierto”, teoriza a partir de los resultados.
Esta investigación básica ofrece nuevas pistas para entender mejor el funcionamiento de las células madre. En concreto, los cambios en la cromatina durante los procesos de reprogramación y diferenciación celular. Por ejemplo, este conocimiento podría contribuir a entender mejor la fisiología del cáncer observando la arquitectura interna de una célula cancerígena. “Quizás tengan una estructura diferente”, especula Cosma.
En el CRG también confían en poder aplicar el hallazgo a desarrollar un sistema para discernir de forma más ágil el grado de pluripotencia de una célula madre reprogramada (iPS) a partir de una adulta en el laboratorio. Las iPS son una viga de la medicina regenerativa, cuyo objetivo es extraer células adultas del paciente, transformarlas en células madre y emplearlas para regenerar sus tejidos dañados. “Los test que utilizamos para diferenciar entre las iPS humanas buenas y menos buenas son muy trabajosos”, comenta Cosma, que ha dedicado parte de su investigación a la inducción de células madre y la reprogramación de células madre de retina.
Hasta ahora la tecnología no permitía identificar la cantidad y la posición de los nucleosomas en células vivas. “Probablemente veremos una explosión de la nueva biología en los próximos años gracias a las aportaciones de la microscopía fluorescente de superresolución”, comenta Melike Lakadamyali, la investigadora del ICFO que ha manipulado el microscopio STORM, ganador del Nobel.
Esta técnica, con un coste de entre 200.000 y 500.000 euros, mejora la calidad de las imágenes a 20 nanómetros. Un microscopio óptico convencional las conseguía a 300 nanómetros a causa de la difracción. Sin embargo, Lakadamyali apunta que la superresolución es una técnica “aún relativamente lenta” en comparación con sus predecesoras. Añade que el método deberá mejorar la velocidad para captar las dinámicas celulares con precisión de milisegundos.
La nanoscopía ya se había utilizado para visualizar otros procesos biológicos como la división del núcleo celular, pero “la mayoría de estudios previos se habían basado en la prueba de concepto”, contextualiza Lakadamyali sobre la nueva tecnología que permite observar el ADN y los nucleosomas.
Su grupo es pionero en la utilización de este microscopio para observar la cromatina y los nucleosomas en combinación con aproximaciones cuantitativas y simulaciones numéricas en células humanas de piel e iPS (reprogramadas), así como en células de ratón embrionarias y precursoras de neurona. La biología celular y la neurociencia, asegura Lakadamyali, son los dos campos que más se pueden beneficiar de esta tecnología.
No hay comentarios:
Publicar un comentario